How much difference can a tenth of a nanometer make? When it comes to figuring out how proteins work, an improvement in resolution of that miniscule amount can mean the difference between seeing where atoms are and understanding how they interact.
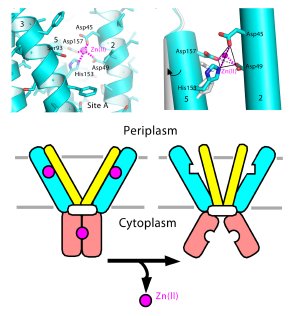 Upper and Middle Panels: Atomic details of zinc binding to the zinc transporter protein, known as YiiP. Lower panel: A cartoon illustrating how zinc binding may change the protein shape to regulate the coordination geometry of the active site for zinc transport (shown as a tetrahedron in middle panel).
Upper and Middle Panels: Atomic details of zinc binding to the zinc transporter protein, known as YiiP. Lower panel: A cartoon illustrating how zinc binding may change the protein shape to regulate the coordination geometry of the active site for zinc transport (shown as a tetrahedron in middle panel).
Case in point: New, improved-resolution views of a zinc transporter protein deciphered at the U.S. Department of Energy's Brookhaven National Laboratory provide not just a structure but also a suggested mechanism for how cells sense and regulate zinc, an element that is essential for life, but which must be kept at a steady state to avoid problems like seizures, diabetes, and possibly Alzheimer’s disease.
The new findings, to be published online on September 13, 2009, by Nature Structural & Molecular Biology, also suggest targets for zinc-regulating drugs, and may even advance the understanding of similar zinc-regulating enzymes in plant chloroplasts with possible implications for biofuel production.
“Our goal is to reveal atomic interactions in a protein structure to understand the chemistry that underlies the protein’s biological function,” said Brookhaven biologist Dax Fu, who led the research. “With this structure, we can begin to understand the mechanism of zinc transport at a chemical level.”
The structure was revealed using x-ray crystallography at Brookhaven Lab’s National Synchrotron Light Source (NSLS), a source of intense x-ray, ultraviolet, and infrared light. By studying how x-rays bounce off crystallized samples of a protein, scientists can reconstruct the location and orientation of the protein’s atoms in three dimensions.
The Brookhaven team had previously used NSLS to solve a zinc transporter protein structure at lower resolution*. To achieve the new-and-improved structure, the scientists added mercury atoms to stabilize protein packing in the crystals. This increased the resolution of their x-ray vision by a mere angstrom (tenth of a nanometer). But because it brought the overall resolution of their structure to just below 3 angstroms — the point at which individual atoms begin to become visible — it enabled the scientists to see the protein in action as it bound to and transported zinc ions.
Using fluorescent probes, the scientists also studied how the protein changed shape in response to zinc binding. And they tested how changes to structural elements of the zinc transporter protein would affect its ability to transport zinc.
Together, these experiments suggest an auto-regulatory mechanism for zinc transport: Zinc binding within the cell triggers hinge-like movements of two electrically repulsive portions of the protein that lie within the cell’s interior, which results in a conformational change in the portion of the protein that traverses the cellular membrane. So when zinc levels inside the cell rise too high, this shape shifting somehow pushes zinc ions through the membrane and out of the cell.
“Exactly how the protein pushes the zinc ions through the membrane has yet to be determined,” said Fu, who added that this will be a focus of future research.
Conceivably, he added, drugs that bind to the zinc-sensing portions of the protein could be used to modulate zinc transport activity and help adjust zinc levels as possible treatments for diseases such as seizure disorders or diabetes. Brookhaven Science Associates, which manages Brookhaven Lab, has filed a patent application related to this work.
In addition, because other metal transporting proteins share similar architecture with the zinc transporter protein, the findings from this study may advance the understanding of other medical disorders linked to metal imbalance, as well as the development of possible treatments for those conditions.
Furthermore, this work may have implications for researchers trying to improve the prospects of biomass production in plants, an essential component to the development of biofuels. Zinc is an essential co-factor in a host of reactions in chloroplasts, the site of photosynthesis. But as is the case in animals, excess metals can be highly toxic in plants. Consequently, studies to help elucidate zinc-transporter protein function could help scientists understand how plants maintain the delicate balance needed for ideal growth.
Future studies of protein structures at Brookhaven Lab promise to reveal even greater mechanistic detail when a new light source, known as NSLS-II, opens in 2015. That facility, now under construction, will be 10,000 times brighter than NSLS. That boost in brightness — and therefore resolution — would be particularly important in the study of membrane proteins, which represent the vast majority of proteins of interest to those developing drugs, but which are also often difficult to crystallize.
“As illustrated by this study, even small improvements in x-ray diffraction resolution can greatly advance our mechanistic understanding of protein function,” said Fu.
This research was performed at beamline X25A at the NSLS. The work was supported by the National Institutes of Health, DOE’s Office of Science (Office of Basic Energy Sciences), and by the Biology Department at Brookhaven Lab.