Before one of your muscles can twitch, before the thought telling it to flex can race down your nerve, a tiny floodgate of sorts-called an ion channel-must open in the surface of each cell in these organs to let in the chemical signals that spur the cell to action. New research* at the National Institute of Standards and Technology (NIST) has allowed scientists to observe ion channels within the surface membrane for the first time, potentially offering insights for future drug development.
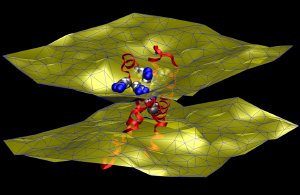 An imaging technique known as neutron diffraction, used along with molecular simulations, revealed that an ion channel’s voltage sensing domain (red, yellow and blue molecule at center) perturbs the two-layered cell membrane that surrounds it (yellow surfaces), causing the membrane to thin slightly. Credit: NIST
An imaging technique known as neutron diffraction, used along with molecular simulations, revealed that an ion channel’s voltage sensing domain (red, yellow and blue molecule at center) perturbs the two-layered cell membrane that surrounds it (yellow surfaces), causing the membrane to thin slightly. Credit: NIST
Because they function as gatekeepers for messages passing among nerve cells, ion channels are the target of a host of drugs that treat psychological and neurological issues. But because the proteins that form the channels are hard to observe, obtaining knowledge of their operation has proved difficult. Studies of the proteins have been limited to either the molecules in isolation or dried and crystallized to get an idea of their structures. Now, a multi-institutional team working at NIST’s Center for Neutron Research (NCNR) has provided a glimpse of the proteins in their naturally occurring form and interacting with the surrounding cell membrane.
The findings, just reported in the journal Nature, improve our understanding of the moving portion of the ion channel that responds to voltage differences across the cell membrane, according to team leader Stephen White. While the work may not be of practical medical use for some time, he says, it is a useful step toward understanding how signals travel-particularly among neurons.
“All of the communications in the body are electrical,” says White, a biophysicist at the University of California, Irvine. “The motion of life depends on ion channels responding to voltage differences, so that they open and close at just the right moment, controlling the use of energy. Without them, nothing would happen in the body.”
By investigating this portion of the ion channel, called a voltage-sensing domain, the team has provided science’s first glimpse of how an ion channel’s shape and motion affects the cell membrane, which in turn helps protect and stabilize the proteins that form the channel. White says further research could lead to a complete picture of how ion channels function.
“We still can’t see in detail how the gate opens and closes, but that’s our eventual goal,” White says. “We hope that someday we’ll be able to detect the motion of these voltage-sensing domains in their up and down states.”
The research team, jointly headed by White and Kenton Swartz of the National Institute of Neurological Disorders and Stroke (NINDS), also includes scientists from the University of Missouri, the National Institute of Alcohol Abuse and Alcoholism and the NCNR. Funding for the study was provided by the National Science Foundation, the National Institute of General Medical Sciences and NINDS.
* D. Krepkiy, M. Mihailescu, J.A. Freites, E.V. Schow, D.L. Worcester, K. Gawrisch, D.J. Tobias, S.H. White and K. Swartz. Structure and hydration of membranes embedded with voltage-sensing domains. Nature, 462, pp. 473-479 (Nov. 26, 2009), doi:10.1038/nature08542.