Sep 10 2012
In living systems, complex nano- and microscale structures perform a host of physical and biological functions. While two-dimensional patterns can be recreated fairly well with techniques like microlithography, three-dimensional structures represent a big challenge. In the journal Angewandte Chemie, American researchers have now reported a new method for the lithography-free etching of complex surface motifs with the use of biodegradable polymers and enzymes. Starting with structured microchannels, they have built an assembly for the isolation and concentration of cells from whole blood.
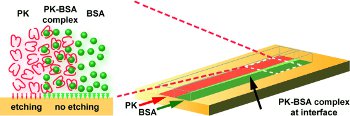
A team led by Victor M. Ugaz at Texas A&M University uses proteinase K (PK), a protein-cleaving enzyme that can also break down the bioplastic polylactic acid. First, the researchers apply a mask to a small block of polylactic acid, leaving only a narrow trail. The liquid containing PK is directed through this microchannel. Wherever the enzyme comes into contact with the polylactic acid, the latter is etched away.
Within microchannels, liquids can flow past each other without appreciable mixing. The researchers use this phenomenon to make structured channels. They direct PK solution through the channels on the left and right, while allowing a protein solution flowing through the middle to inhibit the etching process. This etches neighboring channels separated by a "weir" into the polymer. In the next step, a protein solution is directed through one of the etched channels and over the central weir, while the second channel is further etched with PK. This allows one channel to remain flat while the second is made deeper. Finally, all three "tracks" are made even deeper with PK. This causes the top of the weir to be lower than the outer edges of the double channel.
To make their device, the researchers bent one such channel into a hairpin turn and put a lid over it. They allow blood spiked with tumor cells to flow through the inner, flatter channel. A buffer solution flows through the deeper outer channel. In the curve, centrifugal forces push blood cells into the outer track with the buffer. However, the small space between the top of the weir and the lid over the system only allows small blood cells to pass through. The larger tumor cells do not fit through and become more concentrated in the inner channel as the red blood cells become less concentrated. The different depths of the channels enhances this process. Rare cells like freely circulating tumor cells can be detected much more rapidly and easily when blood samples are tested by this method than by conventional methods like membrane filtration.
Special thermal preparation allows for the targeted formation of crystalline regions in the polylactic acid. PK does not degrade these regions well. This allows for the formation of defined small obstacles within the channels, which could be useful in filtration or chromatography systems.
Source: Wiley.